近日,基础医学院汪秀星教授与北卡罗来纳大学教堂山分校Jeremy N. Rich教授、南京医科大学基础医学院张茜副教授、南京医科大学公共卫生学院钱旭教授、南京医科大学第一附属医院神经外科张军霞教授在《自然▪细胞生物学》(Nature Cell Biology)发表题为《抑制巨噬细胞来源乳酸转运激活cGAS-STING信号并增强胶质母细胞瘤的抗肿瘤免疫》(Inhibiting macrophage-derived lactate transport restores cGAS-STING signaling and enhances antitumour immunity in glioblastoma)的研究论文。该研究揭示了肿瘤微环境中的乳酸在胶质瘤干细胞与巨噬细胞间的穿梭转运新机制,揭示乳酸化修饰促进胶质瘤干细胞自我更新并重塑免疫抑制微环境的关键作用,发现靶向干预肿瘤微环境乳酸转运及乳酸化修饰蛋白能为临床抗肿瘤免疫治疗提供了极具转化潜力的新思路。

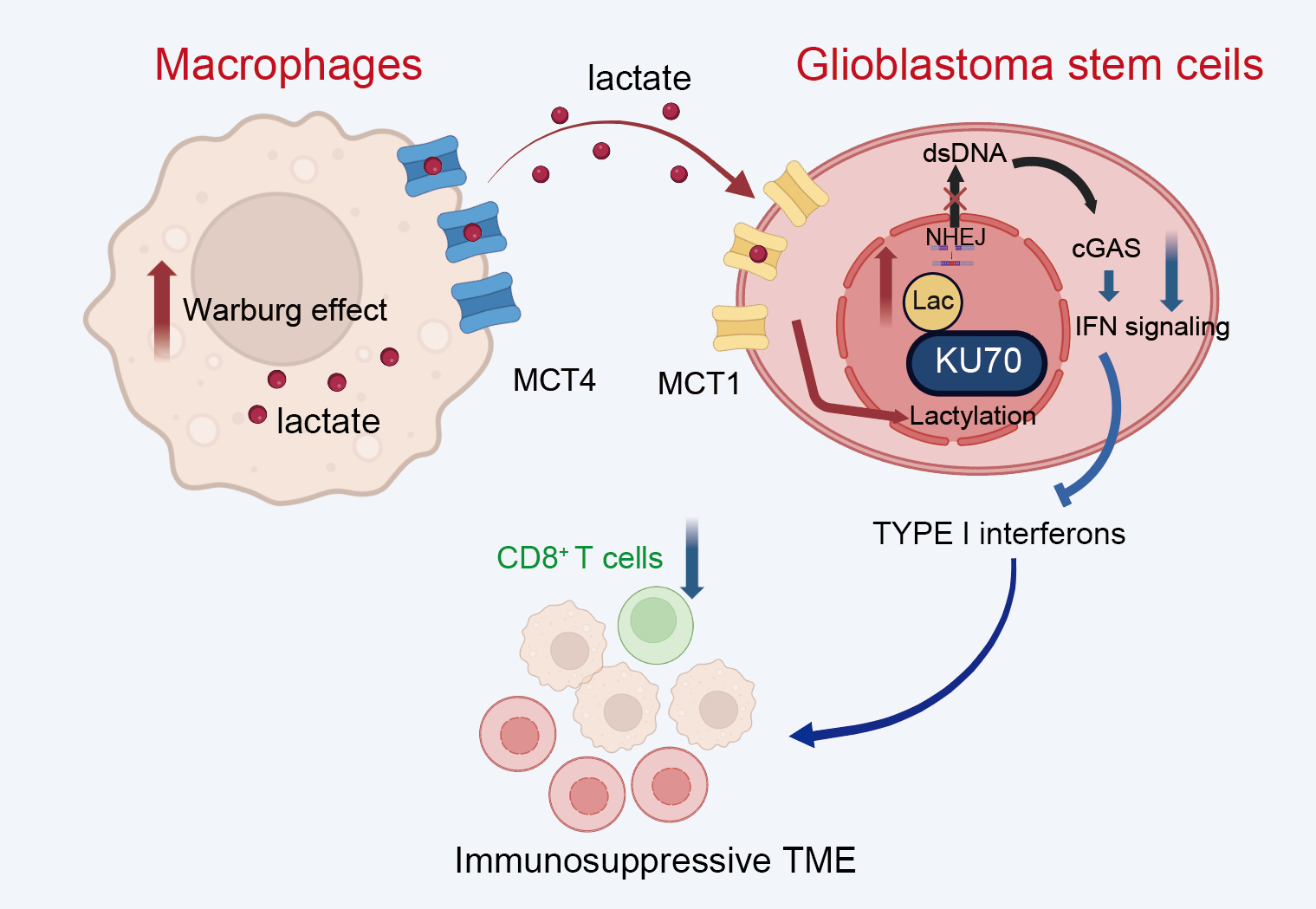
胶质母细胞瘤(GBM)是中枢神经系统最具侵袭性的原发恶性肿瘤,其高恶性程度由复杂的肿瘤微环境驱动。胶质瘤干细胞(GSCs)作为肿瘤微环境的核心“引擎”,兼具自我更新、成瘤驱动、免疫逃逸及干细胞特性,并呈现独特的代谢重编程—高度依赖有氧糖酵解(Warburg效应)产出大量乳酸。肿瘤来源的乳酸主要通过酸化微环境或抑制抗肿瘤免疫细胞发挥免疫抑制功能。然而,近年发现的全新蛋白质翻译后修饰—乳酸化,可将乳酰基共价连接至组蛋白或非组蛋白,直接调控基因表达与蛋白功能,为乳酸赋予“信号分子”新身份。肿瘤微环境中非肿瘤组分的代谢特征如何?非肿瘤细胞来源的乳酸能否通过乳酸化修饰调控GSCs干性、代谢或免疫逃逸?这一调控机制仍是未知领域。
团队通过对GBM患者的单细胞转录组分析发现,糖酵解信号在巨噬细胞中异常富集,乳酸外排蛋白MCT4在巨噬细胞中高表达,乳酸摄取蛋白MCT1在干细胞样的肿瘤细胞中高度表达。巨噬细胞通过MCT4分泌乳酸促进GSCs干性功能,GSCs通过MCT1摄取巨噬细胞来源乳酸促进GSCs增殖更新。进一步地,研究者发现GSCs中乳酸化在DNA损伤修复非同源末端连接通路(NHEJ)的KU70赖氨酸317(K317)乳酸化位点高度富集,并证明KU70的K317位点乳酸化修饰促进GSCs自我更新与干性维持。基于上述发现,靶向乳酸转运蛋白MCT1-MCT4双重抑制剂昔洛舍平或针对KU70乳酸化位点设计的穿膜肽,联合PD-1抑制剂能够有效地促进CD8+ T细胞的浸润,增强了抗肿瘤效应,为临床转化提供理论依据。该研究揭示了MCT1-MCT4介导的乳酸在巨噬细胞与GSCs细胞间的穿梭转运信号机制,GSCs通过摄取微环境中乳酸促进乳酸化修饰NHEJ修复途径促进GSCs增殖与更新,初步验证了靶向KU70乳酸化位点的穿膜肽在GBM治疗策略中的可行性。该研究将肿瘤代谢、表观修饰和免疫逃逸三线合一,为把“冷肿瘤”转为“热肿瘤”提供了可转化的新靶点,也为较难攻克的脑肿瘤GBM带来新的治疗突破口。
南京医科大学博士毕业生/北卡罗来纳大学教堂山分校博士后李大奇、南京医科大学研究生崔高源、爱荷华大学Kailin Yang博士、南京医科大学第一附属医院神经外科陆晨飞博士、南京医科大学研究生江雨韩、南京医科大学分析中心张乐为本文的共同第一作者。南京医科大学基础医学院汪秀星教授、北卡罗来纳大学教堂山分校Jeremy N. Rich教授、南京医科大学基础医学院张茜副教授、南京医科大学公共卫生学院钱旭教授、南京医科大学第一附属医院神经外科张军霞教授为本论文共同通讯作者。此工作得到国家高层次人才青年项目、国家自然科学基金青年科学基金A类、国家自然科学基金面上项目、江苏省特聘教授等项目资助。
原文链接:
https://www.nature.com/articles/s41556-025-01839-y
(供稿/汪秀星、张茜课题组;审核/陈峰、王觉进)