近日,基础医学院汪秀星教授与首都医科大学附属北京天坛医院张伟教授、匹兹堡大学医学中心Jeremy N. Rich教授、南京医科大学第一附属医院神经外科尤永平教授在《自然▪通讯》(Nature Communications)发表题为“联合靶向不同细胞状态的胶质瘤干细胞阻断肿瘤恶性进展(Combined targeting of glioblastoma stem cells of different cellular states disrupts malignant progression)”的研究论文,该研究发现经典型(CL)和间充质型(MES)胶质瘤干细胞占比较高的患者生存预后较差,联合靶向CL和MES亚型胶质瘤干细胞有望成为胶质母细胞瘤的新型临床治疗方案。

胶质母细胞瘤(GBM)是中枢神经系统高侵袭性和致死性的原发恶性肿瘤。胶质瘤干细胞(GSC)是肿GBM内部具备自我更新、多向分化能力的一类细胞,被认为是肿瘤发生、复发及治疗抵抗的“种子”。既往的研究将GSC视为单一的群体,使用特定的标记物对其进行鉴定。然而,经典的GSC标记物表现出异质性的转录分布特征,提示GSC同样具备异质性。目前,针对GSC异质性特征及其作用机制的研究领域仍较为空白。
研究团队通过对GBM患者的单细胞转录组、GSC转录组等多组学数据联合分析,发现不同患者体内的GSC分子亚型占比存在差异,CL和MES亚型占比较高的GBM患者生存预后较差。进一步利用多组学联合分析,筛选发现了CL亚型GSC特征靶点MEOX2和MES亚型GSC特征靶点SRGN。在CL亚型GSC中,MEOX2通过调节Notch信号通路维持GSC干性和CL亚型特征。在MES亚型GSC中,SRGN通过维持NFKB1蛋白稳定性进而调节NF-κB信号通路,最终维持GSC的干性和MES亚型特征。利用虚拟分子筛选联合体内外实验验证,发现了靶向MEOX2和SRGN的FDA批准药物尼洛替尼和帕利哌酮。最终通过异质性小鼠模型,验证明确联合靶向CL和MES亚型GSC能够有效抑制肿瘤恶性进展。
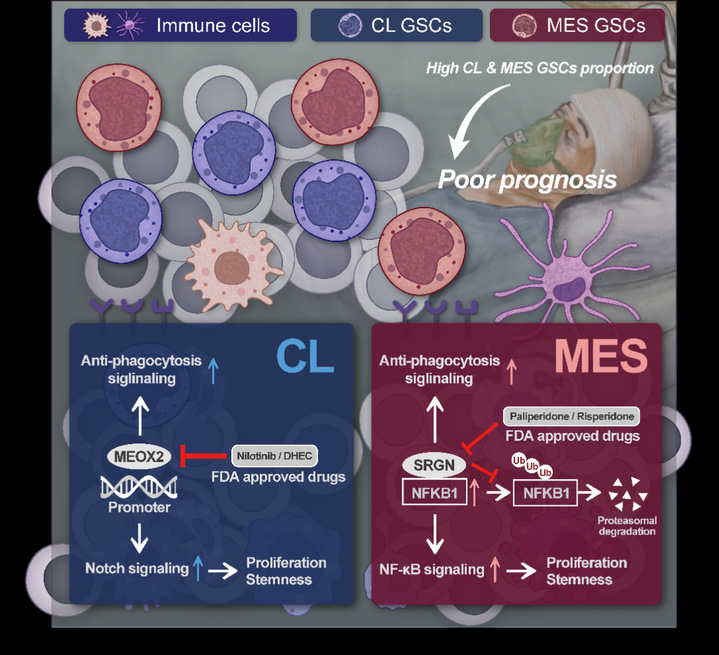
该研究揭示了MEOX2和SRGN分别作为CL和MES亚型GSC特征靶点的分子作用机制,初步验证了靶向CL和MES亚型GSC的新型GBM治疗策略可行性。目前,以该研究为基础的研究者发起的临床试验正在进行当中。
南京医科大学第一附属医院神经外科陆晨飞博士后,南京医科大学基础医学院康涛硕士,南京医科大学第一附属医院神经外科张军霞教授,克利夫兰医学中心Kailin Yang博士,南京中医药大学医学院刘阳副教授为本文的共同第一作者。南京医科大学基础医学院汪秀星教授,首都医科大学附属北京天坛医院张伟教授,匹兹堡大学医学中心Jeremy N. Rich教授,南京医科大学第一附属医院神经外科尤永平教授为本论文共同通讯作者。此工作得到国家高层次人才青年项目、国家自然科学基金、江苏省自然科学基金、江苏省特聘教授等项目资助。
原文链接:
https://www.nature.com/articles/s41467-025-58366-5
(供稿/汪秀星课题组;审核/陈峰、王觉进)