近日,南京医科大学基础医学院姚兵副教授团队在《Cell Reports》杂志在线发表了题为《HIF-1α drives resistance to ferroptosis in solid tumors by promoting lactate production and activating SLC1A1》的研究论文。该研究揭示了实体肿瘤中缺氧微环境是导致铁死亡抵抗的主要因素,而缺氧诱导因子HIF-1α是其主驱动器。HIF-1α上调SLC1A1提升谷氨酸-胱氨酸转运效率进而驱动实体肿瘤抵抗铁死亡,同时促进LDHA激活的乳酸堆积促进铁死亡抵抗。并且,HIF-1α抑制剂联合铁死亡诱导剂可成为实体肿瘤治疗的新策略。

“铁死亡”是一种新型程序性细胞死亡方式,由细胞膜上铁依赖性的不饱和脂肪酸发生脂质过氧化驱动。不同于体外细胞模型的良好疗效,此前研究发现铁死亡诱导剂在动物体内对实体肿瘤疗效一般,这阻碍了铁死亡诱导剂及相关疗法在临床的进一步应用。
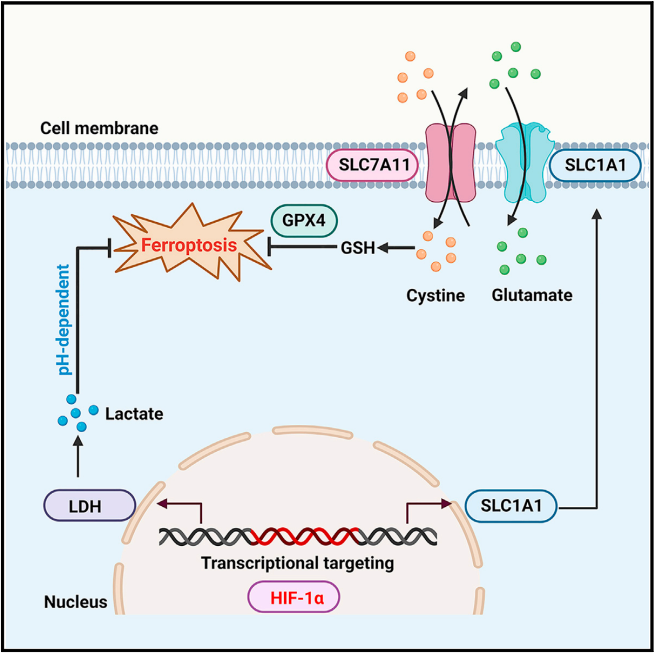
在本项研究中,姚兵课题组发现缺氧导致铁死亡抵抗在实体肿瘤中普遍存在,是一个共性特征。HIF-1α是缺氧抵抗铁死亡的主要驱动因素,且可抵消HIF-2α对铁死亡的增敏作用。乳酸以pH依赖的方式有效促进铁死亡抵抗,并且乳酸脱氢酶LDHA和LDHB的双重敲除有效促进了铁死亡敏感性。HIF-1α作为SLC1A1上游转录因子,可以激活其表达,促进谷氨酸摄取,进而交换更多细胞外胱氨酸,最终导致铁死亡抵抗。基于以上基础实验,研究人员提出HIF-1α抑制剂(Digoxin, DIG)联合铁死亡诱导剂(SAS)作为实体肿瘤治疗的新策略。DIG联合SAS比任一单药更有效地诱导皮下瘤铁死亡的发生,抑制肿瘤生长。
这些发现不仅阐明缺氧诱导实体肿瘤铁死亡抵抗的分子机制,同时为实体肿瘤的治疗提供新的理论和策略。
我院姚兵副教授为论文的通讯作者,南京大学曾科教授、复旦大学向俊教授和南京医科大学第一附属医院秦超教授为本文共同通讯作者。该研究得到了国家自然科学基金、国家重点研发项目、江苏省高等学校自然科学研究面上项目等多项资金的大力资助。
论文第一单位为基础医学院国家级基础医学实验教学中心,基础医学院20级本科生周婧婉为论文共同作者。近年来,基础医学院以“式闾计划”为平台,围绕“激发学生双创兴趣,促进学生综合发展”的目标,结合学院学生专业特点,夯实学生基础科研知识和实验技能,有力推进本科生科研能力与双创教育融合发展,人才培养质量不断提升。
(供稿/姚兵课题组;审核/陈峰、郭兴)