2023年5月15日,我校基础医学院及生殖医学与子代健康全国重点实验室刘星吟教授课题组在代谢领域顶级期刊《细胞代谢》(Cell Metabolism)在线发表研究论文《植物乳杆菌及其代谢物吲哚-3-乳酸调控CD8+T抗结直肠肿瘤免疫功能和机制研究》 (“Lactobacillus plantarum-derived indole-3-lactic acid ameliorates colorectal tumorigenesis via epigenetic regulation of CD8+ T cell immunity ”),揭示了肠道微生物及其衍生代谢产物吲哚-3-乳酸(indole-3-lactic acid,ILA)通过改变染色质的可及性增强CD8+T细胞抗结直肠肿瘤免疫的表观遗传学新机制。

肠道微生态失衡以及肠道微生物衍生代谢物的改变与结直肠癌有关。先前的研究表明,肠道益生菌,包括乳杆菌和双歧杆菌,在小鼠模型中具有改善炎症性肠病和结直肠癌发生发展的作用。然而肠道微生物产生的代谢物如何增强CD8+T细胞抗肿瘤功能的分子机制清楚并不清楚。
在本研究中,研究人员相继构建了急性小鼠肠炎模型,原位化学诱导的结直肠癌动物模型,结直肠癌皮下瘤模型,发现植物乳杆菌及其衍生的代谢物ILA能显著改善了小鼠的肠道炎症、肠道微生态失衡,抑制了结直肠癌肿瘤的生长。通过注射抗CD8抗体到皮下瘤小鼠以及荷瘤免疫缺陷Rag1−/−小鼠,研究者证实ILA的抑瘤作用部分是由肿瘤浸润的CD8+T细胞介导。 接下来,研究者又通过转移经ILA诱导BMDCs 和CD8+T细胞到荷瘤小鼠进一步证实,一方面ILA通过增强IL12a增强子区域周围的H3K27ac富集和染色质可及性来促进DCs的IL12a产生,从而启动CD8+T细胞的抗肿瘤活性,另一方面它也可以直接增强肿瘤侵润CD8+T细胞分泌IFN-γ+ GzmB+而起到杀伤肿瘤细胞的功能。
为了进一步揭示ILA增强肿瘤侵润CD8+T细胞的分子机制,研究者通过体内和体外实验证实ILA通过与CD8+T 细胞的染色质绝缘子蛋白CTCF相互作用,改变染色质的可及性,调控了CD8+T细胞中 CTCF与转录活性边界的差异结合并降低CD8+T细胞中调节胆固醇代谢的重要基因Saa3的表达,进而降低CD8+T细胞的胆固醇水平,从而增强肿瘤浸润性CD8+T细胞的功能,抑制肿瘤的生长。
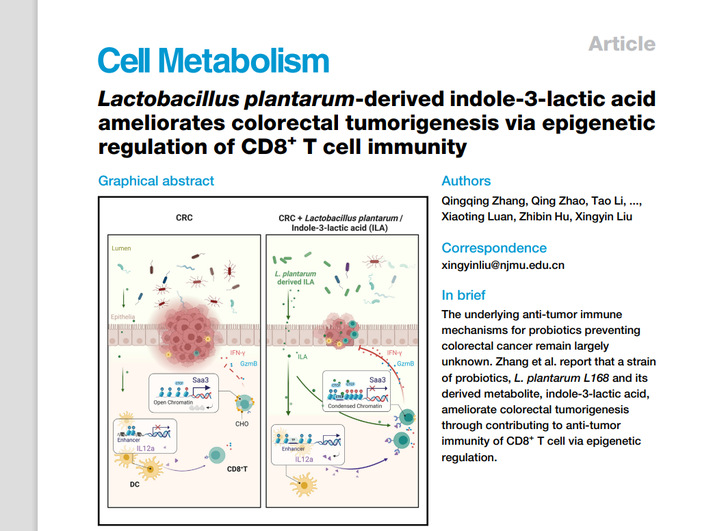
该研究首次阐释了肠道微生物来源的代谢物吲哚-3-乳酸通过调控染色质的可及性进而调控胆固醇代谢影响结直肠癌发生发展的表观遗传学机制,为肠道微生物介导的抗肿瘤免疫的表观遗传学机制提供了全新的见解,为防治结直肠癌的发生提供了重要的理论基础和实验依据。

为该研究做出主要贡献的作者合影 张青青(左二,第一作者,2018级博士研究;赵晴(左一,第二作者,2020级硕士研究生);李涛(右一,第三作者,2019级博士研究生);刘星吟教授(右二)。
南京医科大学基础医学院,江苏省现代病原生物学重点实验室,江苏省人类功能基因组重点实验室,生殖医学及其子代健康全国重点实验室刘星吟教授为该研究论文的通讯作者,南京医科大学基础医学院2018级博士研究生张青青是该论文的第一作者,2020级硕士研究生赵晴是该论文的第二作者,其他对该论文做出重要的贡献还包括刘星吟教授课题组研究生李涛,路龙娅,张鸿,博士后王飞等人,南京医科大学生殖医学与子代健康全国重点实验室胡志斌教授为该研究提供了重要的建议和支持。本研究由国家重点研发计划,国家自然科学基金和南京医科大学姑苏学院重点项目等资助。南京医科大学基础医学院分析测试中心为该项目代谢分析顺利进行提供了重要的技术支持。
原文链接: https://authors.elsevier.com/a/1h4tc5WXUlSvnB
(供稿/刘星吟课题组;审核/苏川、陈峰)