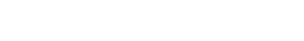基于芬顿或类芬顿反应的化学动力学疗法在近年来受到了研究者们的广泛关注,这种依赖于过渡金属的新型肿瘤治疗手段可以高效地将肿瘤细胞的内源过氧化氢转换成高毒性的羟基自由基。但是,肿瘤细胞内高表达的谷胱甘肽会清除所产生的羟基自由基,降低细胞内的活性氧水平,维持氧化还原平衡。另外,肿瘤细胞会保护性地启动自噬,将氧化损伤的细胞器分解成营养成分,从而减少损伤细胞器的积累,延续细胞的生长。因此,肿瘤细胞内的高谷胱甘肽以及保护性的自噬将会严重影响化学动力学疗法的治疗效率。
由于天然的多孔性、良好的生物降解能力以及易于修饰等特点,近年来纳米尺寸的金属有机框架在化学动力学疗法中得到了有效的应用。相比于三维的金属有机框架,具有二维结构的金属有机框架由于平面的结构、超薄的厚度以及大的比表面积等优势在化学动力学疗法纳米平台的构建上展现了更高的潜力。但是,目前的二维金属有机框架往往需要从三维层状结构剥离得到,但而用剥离的方法很难保留其原有的性质,从而限制了其稳定性。因此,合理地设计具有二维片状结构的金属有机框架对其在肿瘤治疗领域的应用至关重要。
为了克服以上问题,我院林凡教授和南京林业大学游朝群副教授联合东南大学孙柏旺教授开发了一种具有三明治结构的二维纳米片,并通过可激活自噬增强的化学动力学疗法,有效地实现肿瘤靶向治疗,该成果近期发表在《Chemical Engineering Journal》上,标题为“Activatable autophagy inhibition-primed chemodynamic therapy via targeted sandwich-like two-dimensional nanosheets”。
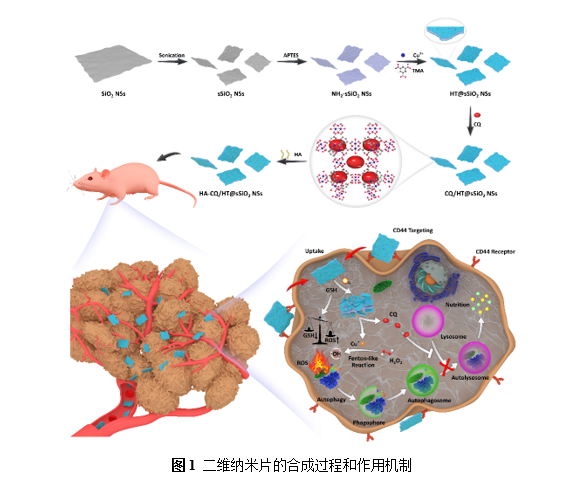
这种采用透明质酸修饰的二维纳米片可以特异性地靶向肿瘤细胞表面过表达的CD44受体并依靠形状优势被快速摄取。随后响应细胞内过表达的谷胱甘肽发生降解,释放类芬顿试剂Cu+和自噬抑制剂氯喹,在破坏氧化还原水平的同时抑制肿瘤细胞的保护性自噬,实现自噬增强的化学动力学疗法。体外实验表明自噬增强的化学动力学疗法对肿瘤细胞具有更高的毒性,能够有效地促进细胞的凋亡,破坏细胞的增殖能力。在小鼠动物模型中,自噬增强的化学动力学疗法可以最大程度地抑制实体肿瘤的生长,且在长时间内并未发现明显的毒副作用。


该项研究的创新性在于设计开发了一种具有三明治结构的二维纳米片用于可激活自噬增强的化学动力学疗法,为二维纳米材料的合理设计及在肿瘤治疗中的应用提供了一定的参考。南京医科大学基础医学院林凡教授、南京林业大学化学工程学院游朝群副教授和东南大学化学与化工学院孙柏旺教授为文章的共同通讯作者,南京医科大学基础医学院博士后吴鸿帅为文章的第一作者。
(供稿/林凡课题组;审核/高威)