近日,南京医科大学基础医学院卢应梅教授课题组、药学院韩峰教授课题组与南京医科大学第一附属医院刘庆淮教授课题组合作在Journal of Clinical Investigation在线发表了题为Endothelium-derived Semaphorin 3G attenuates ischemic retinopathy by coordinating β-catenin-dependent vascular remodeling(内皮源性Semaphorin 3G/β-catenin信号调控改善缺血性视网膜病变机制研究)的研究论文。
该研究发现血管内皮细胞源性分泌蛋白Semaphorin 3G参与缺血性视网膜病变病理过程,并揭示其通过影响内皮细胞β-catenin信号通路调控血管重塑的重要作用。

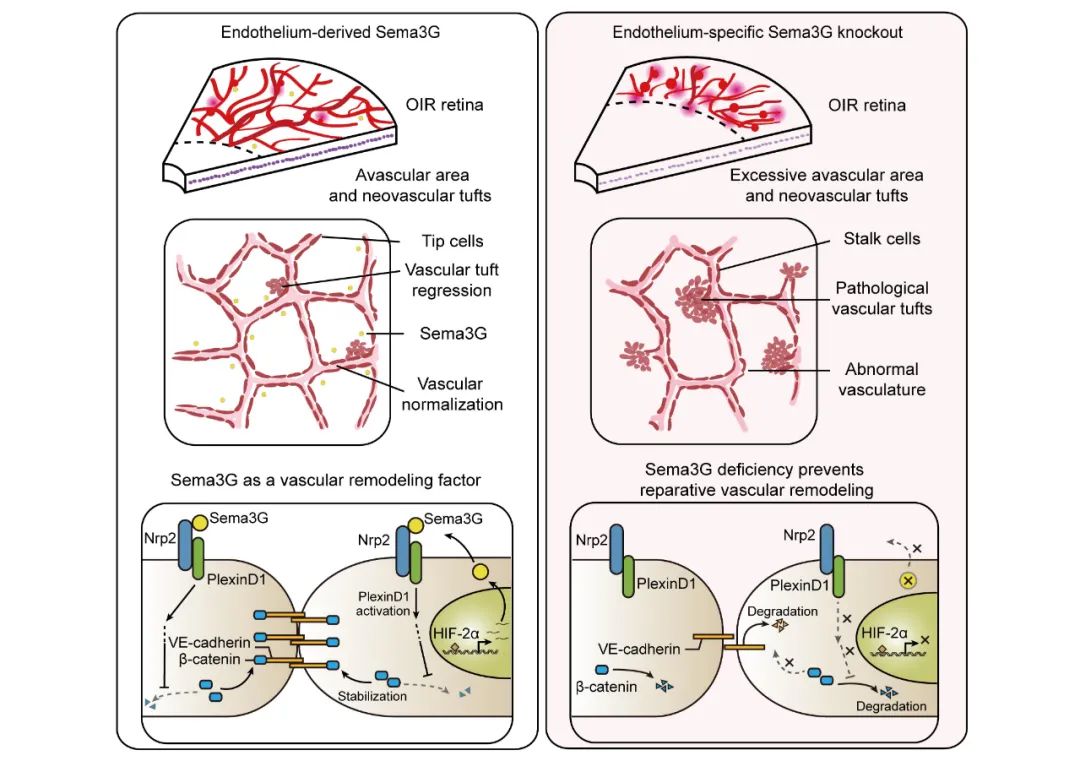
研究者关注到Sema3G在缺血性视网膜病变患者房水中表达增加,提示其潜在临床意义。深入研究发现Sema3G在发育过程中控制着血管细胞外基质的沉积,Sema3G基因敲除导致血管丛的密度下降;高氧诱导视网膜病变(OIR)模型研究结果提示Sema3G参与调控病理性新生血管簇退行过程。进一步,研究者证明低氧条件下,内皮细胞中Sema3G的表达上调,Sema3G结合至血管内皮细胞的Nrp2和PlexinD1受体复合物后,调控β-catenin的稳定性,稳定血管内皮细胞间的黏附连接,进而调控正常血管的再生。此外,经由腺相关病毒介导的血管内皮细胞Sema3G过表达和玻璃体腔注射Sema3G重组蛋白均能有效改善OIR小鼠的病理进程。
由此,研究结果揭示了Sema3G对缺血性视网膜病变病理进程调控的重要性,阐明了Sema3G信号介导病理性新生血管退行和重塑的分子机制。在推进临床治疗缺血性视网膜病变的药物新靶点研究方面迈出了重要一步。
据悉,南京医科大学基础医学院卢应梅教授、药学院韩峰教授、南京医科大学第一附属医院刘庆淮教授为共同通讯作者。共同第一作者陈丹阳和孙宁赫为南京医科大学与浙江大学联合培养的博士研究生。该项目研究获国家自然科学基金资助。该团队的其它学术论文发表在Neuron,Cell Res,Mol Psychiatry,J Exp Med等期刊。
原文链接:
https://www.jci.org/articles/view/135296
(供稿/卢应梅教授课题组)