在全球范围内,酒精性肝病(ALD)位居肝脏疾病中发病率和死亡率之首,包括酒精性脂肪肝、酒精性肝炎、及其引发的肝癌和肝硬化。根据世界卫生组织数据,全世界大约一半的肝硬化患者都饮酒,每10万人中有7.2人死于与酒精相关的肝硬化。表象背后,由健康问题衍生的经济负担则更为惊人。以欧盟各国为例,由酒精性肝病(以下简称ALD)造成的直接与间接损失达到1400-8850亿欧元,约占是欧盟各国国民生产总值的2-5%。由此可见,由ALD引发的健康乃至经济社会问题值得关注。
炎症一直伴随ALD发展始终。酒精的摄入增加肠道通透性,使得大量肠道细菌内的毒素得以透过肠壁经血液渗入肝脏,启动肝脏炎症反应。研究表明,使用抗生素清除肠道菌群来屏蔽肝脏炎症的猝发因素,可有效抵御酒精饲料诱导的脂肪沉积,从侧面佐证炎症是肝脏脂代谢紊乱的祸首之一。然而这种炎症对ALD的促进现象尚未从分子机制层面加以解释。
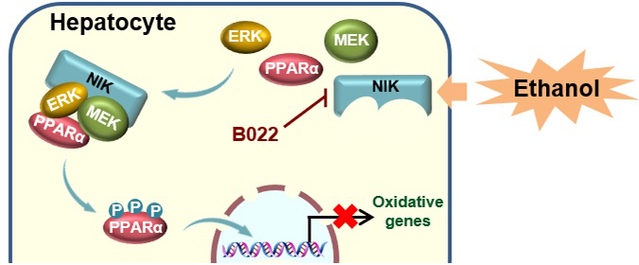
最近,南京医科大学基础医学院药理学系盛亮课题组发现,NIK (NF-κB inducing kinase),作为NF-κB炎症通路的上游组分,在患有ALD的人和小鼠肝脏中异常激活;当肝脏特异性敲除NIK可维持小鼠肝脏脂肪酸氧化能力,保护小鼠免于酒精性脂肪变性。就分子机制而言,NIK招募了MEK1/2和ERK1/2形成一个复合体,通过催化PPARα磷酸化抑制其转录活性,从而使脂肪酸氧化的相关基因表达被抑制。重要的是,对NIK的药理学干预显著减轻了ALD小鼠的酒精性脂肪变性,证明干预NIK对于ALD的治疗价值。该成果近日在《诊断治疗学》在线发表。

盛亮团队指出,NIK不仅仅是MEK1/2和ERK1/2的上游激酶,它同时也是一个“脚手架”,将MEK1/2和ERK1/2锚定在合适的空间位置,帮助信号沿着MEK-ERK通路转导,而且这样的“脚手架”功能不依赖于NIK的激酶活性,说明NIK对MEK-ERK通路的调控存在多个层次。从药物开发的角度思考这个问题,我们认为NIK的降解剂可能比NIK的抑制剂在阻断NIK对MEK1/2和ERK1/2异常调控方面具有更优的效能。
盛亮教授介绍说,“如果将视野扩展一下,我们会发现MEK/ERK是诱导恶性肿瘤异常增殖、侵袭生长和远处转移的一条经典通路;同时, NIK也与肿瘤的发生发展密切相关。NIK与MEK/ERK通路的互动模式是否同样存在于肿瘤之中,干预通路对于肿瘤治疗是否具有价值?这些问题的答案令人期待。”
原文链接:https://www.thno.org/v10p3579.htm
(供稿/盛亮教授课题组)