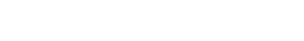韩晓课题组在Cell Reports杂志发表研究论文,揭示FoxO1乙酰化调节因子Ets1参与调控肝脏糖异生的新机制
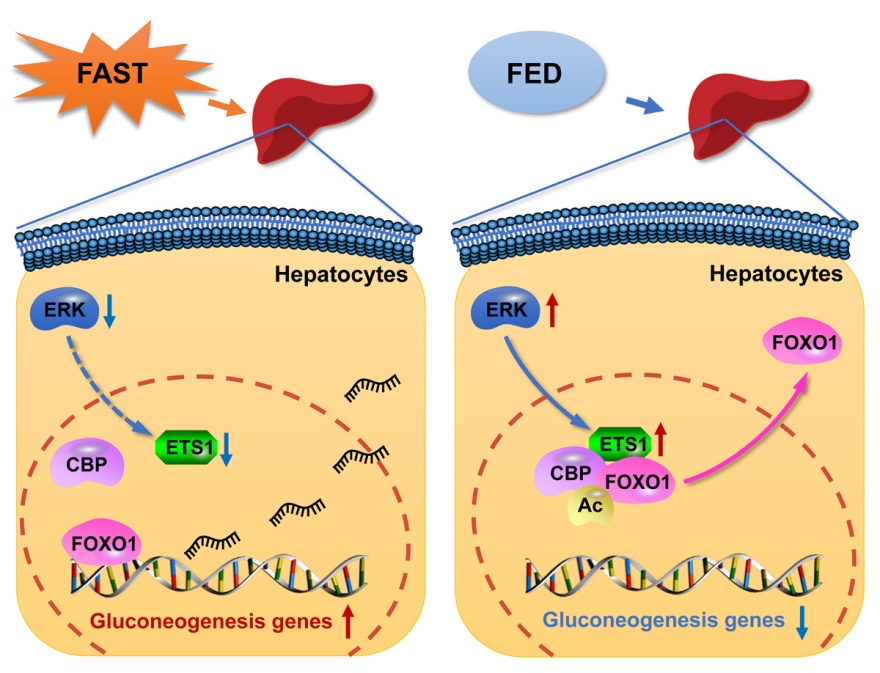
肝脏糖代谢异常是2型糖尿病血糖紊乱的主要特征,其特点是糖异生功能过度激活导致空腹血糖升高。肝脏糖异生作用,因受到胰岛素/胰高血糖素的共同调节,而呈现显著的饥饿-进食周期性。糖异生的动态变化,与转录因子Forkhead box protein O1 (FoxO1)的活性密切相关。FoxO1受到饥饿-进食周期中激素水平的调节,进而靶向调控糖异生途径限速酶,Glucose-6-phosphatase (G6pc)和Phosphoenol-pyruvate carboxykinase (Pck)的表达。尽管FoxO1的下游通路已有很多研究,但饥饿-进食周期是如何动态的调控FoxO1活性,还有很多未知。近些年的研究发现FoxO1 的乙酰化修饰与能量代谢具有相关性,且该修饰水平直接影响了其细胞定位和转录活性。但由于调控FoxO1乙酰化的关键酶CBP并不能够感受饥饿-进食周期,此前并不清楚胰岛素/胰高血糖素是如何动态的调控FoxO1的乙酰化水平。
韩晓课题组的最新研究发现肝脏Ets1可感知饥饿-进食周期并参与调控FoxO1的乙酰化水平。通过对乙酰基转移酶CBP的324个共结合因子进行表达谱分析,筛选出与饥饿-进食周期具有相关性的候选因子,并进一步通过实验验证,发现CBP结合蛋白Ets1具有感知饥饿-进食周期的能力。在分子水平,此研究发现了Ets1能够作为支架蛋白而促进CBP与FoxO1的相互作用,并由此增强FoxO1的乙酰化水平。过表达Ets1可显著抑制FoxO1的转录活性,表现为促进其出核,并抑制其与G6pc启动子区的结合。之后,通过病毒诱导的Ets1肝脏过表达以及Cre-loxp系统诱导的Ets1肝细胞特异性敲除小鼠,进一步发现Ets1在体内具有直接的抑制糖异生的作用。并且过表达Ets1能够有效的降低2型糖尿病小鼠的空腹血糖水平。此项研究不仅揭示了饥饿-进食周期动态调控FoxO1乙酰化的作用机制,加深了我们对糖异生调控网络的了解,并且为控制2型糖尿病空腹高血糖水平提供了新的潜在治疗靶点。此研究还进一步发现了Ets1除了转录因子的作用外,还具有不依赖于转录活性的支架蛋白作用,通过直接的蛋白-蛋白相互作用,发挥调控肝脏糖异生的生物学功能。
该工作于2019年3月发表在Cell Reports杂志, 由博士后李锴、青年教师邱晨、孙鹏共同完成,本项研究获得国家自然科学基金委以及江苏省科技厅的资助。