近日,基础医学院卢春教授团队在《细胞死亡和分化》(Cell Death & Differentiation)在线发表题为《乳酸化NAT10促进tRNASer-CGA-1-1 N4-乙酰胞苷修饰增强肿瘤DNA病毒KSHV再激活》(Lactylation of NAT10 promotes N4-acetylcytidine modification on tRNASer-CGA-1-1 to boost oncogenic DNA virus KSHV reactivation)的研究论文。继首次报道N-乙酰基转移酶10(NAT10)介导的病毒非编码RNA N4-乙酰胞嘧啶(ac4C)修饰在调控卡波氏肉瘤病毒(KSHV)复制中的作用机制后(Nat Commun,2023),该课题组再次从tRNA ac4C修饰与蛋白质乳酸化修饰角度系统阐释了KSHV的复制周期调控新机制。

NAT10是真核生物唯一的调控RNA ac4C修饰的“编辑器”。RNA ac4C修饰在原核生物和真核生物中高度保守,最早发现存在于真核生物tRNA和18S rRNA上,随后证实哺乳动物mRNA也存在ac4C修饰。卢春课题组在过去研究中证实了NAT10能够介导KSHV编码的长链非编码RNA PAN(PAN RNA)ac4C修饰,从而诱导病毒再激活。IFN-γ诱导蛋白-16(IFI16)mRNA也存在NAT10介导的ac4C修饰,通过促进IFI16 mRNA稳定性,激活炎症小体。然而,最为丰富的修饰底物tRNA的ac4C修饰在KSHV再激活中的作用尚未可知。
自2019年发现乳酸驱动的组蛋白乳酸化修饰以来,多种非组蛋白也被证实存在乳酸化修饰,并参与巨噬细胞极化、肿瘤形成、免疫抑制等过程。为了深入探索RNA ac4C修饰与乳酸化修饰对KSHV复制周期的调控作用与机制,卢春课题组在本研究中证实,NAT10蛋白第290位赖氨酸发生乳酸化修饰,并具有上调tRNASer-CGA-1-1 ac4C修饰的作用;KSHV PAN RNA通过促进NAT10与介导其乳酸化修饰的酰基转移酶ATAT1结合,上调NAT10蛋白的乳酸化修饰水平,最终诱导KSHV裂解期基因的翻译和表达,以及子代病毒颗粒的产生。
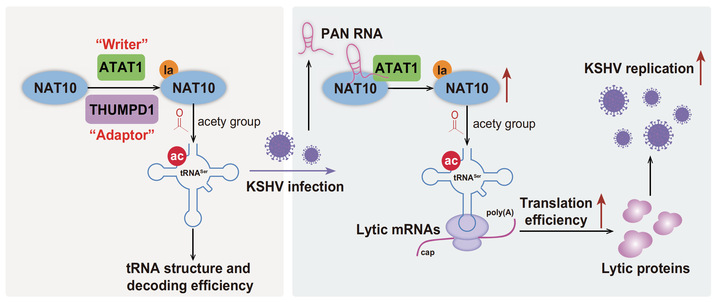
该研究首次从RNA修饰和蛋白质翻译后修饰协同作用的角度,系统阐释了乳酸化NAT10介导的RNA ac4C修饰在KSHV再激活中的作用与机制,为抗病毒感染治疗提供了新思路。
我校基础医学院严沁副教授、周菁博士为本文共同第一作者,基础医学院卢春教授、李婉副教授、严沁副教授及常州市第三人民医院陈国春主任为共同通讯作者。该项研究得到国家自然科学基金、国家重点研发计划等项目资助。
原文链接:
(供稿/卢春课题组;审核/陈峰、王觉进)

