2023年10月10日,南京医科大学基础医学院卢春教授课题组在《Nature Communications》在线发表了题为《NAT10-dependent N4-acetylcytidine modification mediates PAN RNA stability, KSHV reactivation, and IFI16-related inflammasome activation》的研究论文,首次报道了N-乙酰基转移酶10(NAT10)介导的RNA N4-乙酰胞嘧啶(ac4C)修饰在调控DNA病毒复制以及激活炎症小体中的作用机制。

RNA ac4C修饰是在“编辑器”(writer)的作用下,使N4位乙酰胞嘧啶发生乙酰化的化学修饰,在原核生物和真核生物中高度保守。其中NAT10是目前真核生物中发现的唯一调控ac4C修饰的“编辑器”。早期研究发现ac4C修饰存在于真核生物tRNA和18S rRNA上,近期在哺乳动物的mRNA也发现存在ac4C修饰。尽管在RNA病毒基因组中已鉴定出ac4C修饰,但ac4C修饰是否存在于DNA病毒并影响其感染过程,目前仍然未知。
该研究首先证实NAT10介导的RNA ac4C修饰可诱导DNA病毒卡波氏肉瘤病毒(KSHV)的裂解性复制。进一步acRIP-Seq和RIP-Seq结果证实,KSHV编码的多个基因存在ac4C修饰,其中病毒编码的长链非编码RNA PAN(PAN RNA)的丰度最高。突变PAN RNA的ac4C位点将显著抑制病毒裂解基因的表达,并减少病毒颗粒的产生。NAT10通过其介导的ac4C修饰增强PAN RNA的稳定性,从而诱导KSHV再激活。
此外该研究证实,IFN-γ诱导蛋白-16(IFI16)mRNA也存在NAT10介导的ac4C修饰。通常情况下,IFI16在细胞核中感应到病毒DNA后易位至细胞质,激活NF-κB途径并诱导I型干扰素(IFN)的转录,并且可与KSHV基因组相互作用,诱导功能性炎症小体形成。该研究发现,PAN ac4C修饰促进了NAT10与IFI16 mRNA的相互作用,导致IFI16 mRNA发生ac4C修饰、增强其mRNA稳定性和翻译,并最终激活炎症小体。
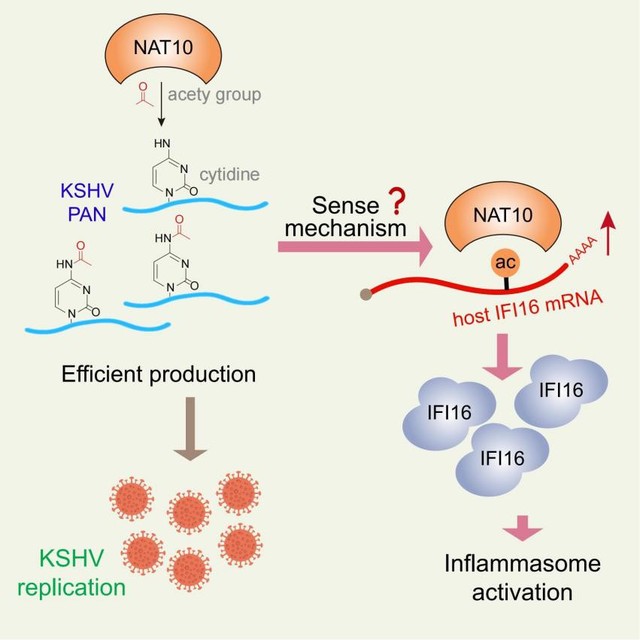
该研究阐释了DNA病毒劫持宿主RNA乙酰化修饰系统促进自身复制,并触发宿主先天免疫的新机制,同时为抗病毒感染治疗提供了新思路。
我院卢春教授、南京医科大学南京市妇幼保健院贾雪梅教授为该论文的共同通讯作者,严沁副教授、博士研究生周菁、硕士研究生王子彧、博士后丁祥亚为共同第一作者。该项研究得到国家自然科学基金、江苏省自然科学基金等资助。
原文链接:https://www.nature.com/articles/s41467-023-42135-3
(供稿/卢春课题组;审核/陈峰、高威)

